INSUFICIÊNCIA VENOSA CRÔNICA DOS MEMBROS INFERIORES
ANATOMIA DO SISTEMA VENOSO DO PÉ
Sistema Venoso Superficial
As veias superficiais da região plantar formam uma rede que se conecta com as veias dorsais superficiais do pé e as plantares profundas. O arco venoso dorsal, no qual desaguam as veias metalarsicas dorsais, continua com a veia safena magna (interna), medialmente, e a veia safena parva (externa), lateralmente.

A veia safena interna, com grande proximidade ao nervo safeno, ascende anteriormente ao maleolo medial; passando-o, continua ascendendo medialmente ao joelho. Ela ascende no compartimento superficial e desagua na veia femoral comum, após entrar na fossa oval. Antes de seu deságüe na veia femoral comum, ela recebe as veias safenas acessórias medial e lateral, assim como pequenas tributárias da região inguinal, da região pudenda e da parede abdominal anterior. As veias do arco posterior drenam a área ao redor do maleolo medial e, então, ascendem na parte póstero-medial da panturrilha. A safena recebe veias perfurantes mediais, chamadas de perfurantes de Cockett, antes de se juntar à veia safena interna, no ou abaixo, do joelho.
A veia safena externa sobe a partir do arco venoso dorsal na região lateral do pé, ascendendo posterior ao maleolo lateral e desaguando na veia poplítea, após penetrar a fascia. O exato ponto de entrada da veia safena externa na veia poplítea é variável. O nervo sural acompanha intimamente a veia safena externa.Terminologia Anatómica
- Veia safena interna ou magna
- Veia pudenda externa
- Veia circunflexa superficial
- Veia epígástrica superficial
- Veia dorsal superficial do clitóris ou pênis
- Veias labiais anteriores
- Veias escrotais anteriores
- Veia safena acessória
- Veia safena externa ou parva
- Rede venosa dorsal do pé
- Arco venoso dorsal do pé
- Veias metatarsianas dorsais
- Rede venosa plantar
- Arco venoso plantar
- Veias metatarsianas plantares
- Veia marginal lateral
- Veia marginal mediai
SISTEMA VENOSO PROFUNDO
As veias digitais plantares do pé esvaziam-se em uma rede de veias metatársicas que compõem o arco venoso plantar profundo. Este continua nas veias plantares medial e lateral que, então, drenam nas veias tibiais posteriores. As veias dorsais do pé formam o par de veias tibiais anteriores no tornozelo.
O par de veias tibiais posteriores, que se localizam ao lado da artéria tibial posterior, corre internamente à fascia do compartimento posterior profundo. Essas veias penetram o solear e juntam-se à veia poplitea, após terem-se unido aos pares de veias fibulares e tibiais anteriores.
Existem grandes seios venosos no músculo solear — os seios soleares — que drenam nas veias tibiais posteriores e fibulares. Existem veias gastrocnêmias bilaterais, que drenam na veia poplitea distalmente ao ponto onde drena a veia safena externa.
A veia poplitea penetra uma janela no adutor magno, a partir da qual é denominada veia femoral, e anteriormente era chamada de veia femoral superficial, pela velha nomenclatura. A veia femoral ascende e recebe a drenagem da veia femoral profunda e, após essa união, passa a chamar-se veia femural comum. Ao cruzar o ligamento inguinal novamente troca de nome: veia ilíaca externa.
Veias perfurantes comunicam os sistema superficiai e profundo, em vários pontos do membro inferior - o pé, nas regiões lateral e medial da perna. As veias perfurantes no pé tanto podem não ter válvulas, como as ter, direcionando o fluxo do sistema venoso profundo para o superficial.PATOLOGIA
VEIAS VARICOSAS
O termo veias varicosas, no senso comum engloba um espectro de dilatação venosa que varia de pequenas teleangiectasias a veias varicosas tortuosas bastante dilatadas.
Como ja citado, para uma caracterização adequada, assim como para escolha do tratamento apropriado, certas definiçoes devem ser compreendidas:
- O termo veias varicosas engloba qualquer veia dilatada, tortuosa, alongada, independentemente do seu calibre.
- Telangiectasias são varicosidades intradérmicas pequenas e tendem ser esteticamente desagradáveis, mas assintomáticas.
- Veias reticulares são subcutâneas e dilatadas, que drenam para tributárias de veias axiais principais ou tronculares.
- Veias tronculares são as nomeadas como veia safena interna e externa
FATORES DE RISCO
Uma combinação de fatores de risco, em vez de qualquer fator de risco isolado, é um preditor melhor da possibilidade de possibilidade de um determinado paciente desenvolver veias varicosas sintomaticas.
A hereditariedade, indubitavelmente, possui um papel importante no desenvolvimento de veias varicosas. Mais uma vez, a falta de uma classificação clara, a variabilidade nos relatos - incluindo a história relatada pêlos próprios pacientes - e a variabilidade nas definições limita a acuracia de qualquer estudo sobre incidência, prevalência e também fatores etiológicos predisponentes.
ESTRUTURA FUNCIONAL DAS VEIAS
A parede venosa é composta das camadas íntima, média e adventícia.
A veia é mais fina e possui menos musculatura lisa e elastina do que a artéria.
A íntima das veias possui uma camada celular endotelial sobre uma membrana basal, enquanto a média é formada por células musculares lisas e elastina/ tecido conjuntivo.
Geralmente, não é apreciado que a adventícia da parede venosa contenha fibras adrenérgicas, particularmente as veias cutâneas. Descargas simpáticas centrais e o centro termorregulador do tronco cerebral podem alterar o tônus venoso, assim como outros estímulos: alterações de temperatura, dor, estímulo emocional e alterações de volume.
As características histológicas das veias variam dependendo do seu calibre.
As vênulas. as menores veias variando de 0,1 a 1 milímetros, contêm a maioria das células musculares lisas, enquanto as veias calibrosas dos membros contém relativamente poucas células musculares lisas. Estas veias de grande calibre têm capacidade contrátil limitada, quando comparadas com a veia safena interna, que possui parede espessa. As válvulas venosas evitam o fluxo retrógrado e é sua falência que leva ao refluxo e aos sintomas associados. As válvulas venosas são prevalentes na proporção distal do membro inferior, conforme progredimos, proximalmente, o número de válvulas diminui até o ponto que deixam de existir, como nas veias cavas superior e inferior.
A maior parte da capacitância da árvore vascular encontra-se no sistema venoso. Devido às paredes finas, relativamente desprovidas de elastina, o sistema venoso é capaz de acomodar grandes alterações de volume, com nenhum aumento de pressão maior que um ponto. As veias têm uma forma normalmente elíptica, até que o limite de sua capacitância seja alcançado; a partir daí, assume uma forma arredondada.
Os músculos da panturrilha aumentam o retorno venoso, funcionando como uma bomba. Na posição supina, a pressão venosa em repouso nos pés é o resultado da energia cinética residual, menos a resistência das arteríolas e esfíncteres pré-capilares. É, então, gerado um gradiente de pressão para o átrio direito de aproximadamente 10 a 12 mmHg, Na posição ortostática, a pressão venosa, com repouso nos pés reflete a pressão hidrostática de uma coluna de sangue desde o átrio até o pé.
O retorno venoso é facilitado pela função de bomba muscular da panturrilha — um mecanismo pelo qual a musculatura da panturrilha funciona como um fole durante o exercício, comprimindo o gastrocnêmio e os seios soleares e impulsionando o sangue em direção ao coração. As válvulas do sistema venoso com funcionamento normal impedem o refluxo de sangue; no entanto, quando uma ou mais dessas válvulas se tornam incompetentes, os sintomas de insuficiência venosa podem desenvolver-se. Durante a contração da musculatura da panturrilha, a pressão venosa do pé e do tornozelo cai dramaticamente. As pressões que se desenvolvem no compartimento muscular, durante o exercício, variam entre 150 e 200 mmHg, e quando há urna falência das veias perfurantes, estas altas pressões são transmitidas para o sistema superficial.
INSUFICIÊNCIA VENOSA SUPERFICIAL
A insuficiência venosa crônica é uma doença extremamente relevante, que acomete pessoas de diferentes faixas etárias e que pode causar sérios problemas socioeconômicos, como, por exemplo, ausência ao trabalho e até mesmo aposentadoria de indivíduos em fase produtiva da vida. Essa doença tem elevadas incidência e prevalência, tendo associação com varizes, úlceras e lesões tróficas de membros inferiores.
O diagnóstico é clínico, e, quando necessário, são utilizados exames complementares.
O tratamento envolve faixas ou meias elásticas, curativos específicos e procedimentos cirúrgicos.
Para muitos pacientes, a doença venosa significa dor, perda de mobilidade funcional e piora da qualidade de vida.
A insuficiência venosa crônica dos membros inferiores (IVCMI) é a incapacidade de manutenção do equilíbrio entre o fluxo de sangue arterial que chega ao membro inferior e o fluxo venoso que retorna ao átrio direito, decorrente da incompetência do sistema venoso superficial e/ou profundo.
Um fato importante sobre as varicosidades é que os sintomas podem ser percebidos em todos as diferentes apresentações da insuficiência venosa. Como visto anteriormente, a anatomia da drenagem venosa do membro inferior se dá de tal forma, que o sistema venoso superficial e profundo podem exibir disfunção valvular independente ou conjuntamente, e insuficiência grave o suficiente para desencadear sintomatologia.
Antes de examinar as causas dos sintomas, é útil tentar identificar fatores predisponentes ao desenvolvimento de veias varicosas e dos seus sintomas.Está claro que, apesar das limitações dos estudos epidemiológicos, as principais influências para o desenvolvimento das veias varicosas são:
- género feminino,
- hereditariedade,
- força hidrostática gravitacional
- forças hidrodinâmicas decorrentes da contração muscular.
Telangiectasias, varicosidades reticulares e veias varicosas são similares fisiologicamente, apesar das variações de calibre. O resultado final comum è: veias dilatadas, tortuosas, alongadas e válvulas com perda parcial ou total da função.
A insuficiência venosa crónica (IVC) resulta em uma gama de sintomas, variando de dor com diferentes graus de intensidade, sensação de peso, edema devido a período prolongado de tempo em posição ortostática ou sentada, nos casos de veias varicosas sintomáticas: até lipodermatosclerose com edema e ulceração no paciente com IVC grave.
A classificação C-E-A-P é um recente sistema de contagem que estratifica a doença venosa baseado no quadro clínico, na etiologia, anatomia e fisiopatologia. O esquema dessa classificação é muito útil para auxiliar o médico a avaliar coerente e cuidadosamente o membro afetado com insuficiência venosa, para então decidir por um plano terapêutico apropriado.QUADRO CLÍNICO
Os pacientes com veias varicosas sintomáticas relatam, muito freqüentemente, como sintomas, a dor, o peso, o disconforto e, algumas vezes, dor muito intensa na panturrilha do membro acometido. Esta piora ao final do dia, principalmente após períodos prolongados de ortostatismo, ou posição sentada, que resultam em distensão venosa e dor.
Os sintomas são, tipicamente, reduzidos ou ausentes pela manhã, desde que o membro não tenha ficado pendente durante a noite. No caso de mulheres, os sintomas são mais incómodos e exacerbados durante o período menstrual, particularmente durante o primeiro ou segundo dias.
Não é incomum um parente possuir refluxo significativo na junção safeno-femoral ou não ter veias varicosas importantes ao exame físico. Adicionamente, o paciente pode ter insuficiência concomitante dos sistemas superficial e profundo e, portanto, um diagnóstico claro devido à ajuda do sistema CEAP será útil em orientar o tratamento.
As veias varicosas primárias consistem em veias superficiais alongadas, tortuosas, que são protuberantes e contêm valvulas incompetentes. Elas produzem sintomas de edema leve. sensação de peso e fatigabilidade fácil. As veias varicosas primárias se misturam imperceptivelmente com IVC mais grave. O edema é de moderado a grave e uma sensação aumentada de peso ocorre com varicosidades mais calibrosas e lesões precoces da pele como pigmentação discreta e enduração do tecido subcutâneo.
Quando a IVC se torna mais grave, um edema pronunciado e uma dor na panturrilha surgem após ficar de pé, sentado ou caminhando. Várias veias dilatadas são vistas agrupadas, em conjunto com pigmentação intensa supramaleolar medial e lateral.
PATOGENIA
Venectasias cutâneas se desenvolvem sob as mesmas influências e podem tornar-se sintomáticas de maneira similar. Os textos sobre doenças venosas, tanto no passado quanto no presente, têm-se referido às venectasias como sendo estéticas e assintomáticas, porém existe ampla documentação demonstrando o contrário.
O tratamento efetivo das venectasias pode aliviar os sintomas de estáse venosa.
Defeitos fundamentais na força e característica da parede venosa participam da patogênese das veias varicosas. Esses defeitos podem ser generalizados ou localizados e consistem em deficiências de elastina e colágeno. Gandhi e colaboradores compararam o conteúdo de elastina e colágeno de veias varicosas com o de veias safenas internas normais, e descobriram um aumento significativo de colágeno e uma redução significativa de elastina nas veias varicosas. Não foi demonstrada diferença na atividade proteolítica; portanto, diminui a possibilidade de que a degradação enzimática seja um componente essencial na formação das veias varicosas.
Diferenças anatómicas na localização das veias superficiais dos membros inferiores podem contribuir para a patogênese.
Por exemplo, o tronco safeno principal não está sempre envolvido na doença varicosa. Talvez porque ele contém uma camada fïbromuscular medial bem desenvolvida e recebe suporte do tecido conjuntivo fibroso que o une à fascia profunda.
Em contraste, as tributárias da veia safena interna recebem menos suporte do tecido subcutâneo gorduroso, e são superficiais à camada membranosa da fascia superficial.
Elas também contêm menos massa muscular em suas paredes, portanto estas, e não o tronco principal, podem tornar-se seletivamente varicosas.
Quando as peculiaridades anatómicas fundamentais são reconhecidas, a competência intrínseca ou incompetência do sistema valvular se torna importante. Por exemplo, a falência da válvula em proteger uma veia tributária das pressões da veia safena interna permite o surgimento de um grupo de varicosidades. Esta não é uma história incomum para mulheres grávidas que descrevem o surgimento súbito de um grupo de varicosidades de causa desconhecida. A falha da proteção valvular é o mecanismo desse surgimento.
O grupo do hospital Middlesex (Londres, Inglaterra) tem feito essas observações nas situações clínicas onde flavonóides purificados e micronizados foram dados como tratamento, durante 60 dias, para pacientes com doença venosa crónica. A monitorização de moléculas de adesão endotelial solúveis revelou que houve uma redução nos níveis de molécula-1 de adesão intercelular, moléculas de adesão celular vascular e lactoferrinas plasmáticas.
Além disso, as veias que comunicam o compartimento profundo com o superficial podem ter uma falência valvular. Estudos sobre a pressão demonstram que existem duas fontes de hipertensão venosa.
- A primeira é gravitacional e resultante do fluxo do sangue venoso em direção distal, através dos segmentos venosos axiais lineares. Trata-se da pressão hidrostática, que é o peso da coluna de sangue desde o átrio direito. As maiores pressões geradas por esse mecanismo são evidenciadas no pé e tornozelo, onde as medidas são expressas em centímetros de água ou milímetros de mercúrio.
- A segunda fonte de hipertensão venosa é dinâmica. Ela é a força da contração muscular, normalmente, contida dentro dos compartimentos da perna. Se as veias perfurantes falham, altas pressões (variando entre 150 e 200 mmHg) se desenvolvem dentro do compartimento muscular, durante o exercício, sendo transmitidas diretamente ao sistema venoso superficial. Aqui, a súbita transmissão de pressão causa dilatação e alongamento das veias superficiais. Pode ocorrer incompetência valvular distal progressiva. Caso as válvulas proximais, como a válvula safeno-femoral, torne-se incompetente, a pressão da contração muscular sistólica é complementada pelo peso da coluna de sangue desde o coração. Além disso, essa coluna se transforma em uma barreira. O fluxo proximal de sangue através da veia femoral extravasa para a veia safena e flui distalmente. Conforme ocorre refluxo distal através de válvulas progressivamente incompetentes, o sangue volta através das veias perfurantes para as veias profundas. Aqui, novamente volta para a veia femoral, somente para ser reciclado distalmente.
Alterações também ocorrem no nível celular. Na área distal lipoesclerótica ocorre proliferação capilar e aumento da permeabilidade capilar, resultante do alargamento dos poros celulares interendoteliais. Há extravasamento transcapilar de partículas osmoticamente ativas, sendo a principal o fibrinogênio. Na IVC, a capacidade flbrinolítica venosa está diminuída e a fibrina extravascular permanece, evitando a troca normal de oxigénio e nutrientes nas células adjacentes.
Entretanto, poucas provas existem sobre uma anormalidade de suprimento de oxigénio para os tecidos. Em vez disso, as pesquisas sugerem que vários processos patológicos estejam envolvidos, e no momento há dificuldade de identificar quais são ativos e quais estão latentes. No futuro, investigações fundamentais sobre esse problema deverão melhorar os cuidados com os pacientes com estáse venosa grave. É importante o entendimento da causa da hipertensão venosa e sua diferenciação em refluxo hidrostático e refluxo hidrodinâmico. A presença daquele implica a necessidade de correção cirúrgica da anormalidade, e a presença deste implica a necessidade de ligadura das veias perfurantes, que permite a exposição da circulação subcutânea às pressões compartimentais.
Influência Hormonal
A função venosa é influenciada por alterações hormonais. Em particular pela progesterona, liberada pelo corpo lúteo para estabilizar o útero, causando relaxamento das fibras musculares lisas. Esse efeito influencia diretamente na função venosa, resultando em uma dilatação venosa passiva, que em vários casos leva à disfunção valvular.
Apesar de progesterona estar implicada no surgimento inicial das varicosidades durante a gestação, o estrogênio também tem efeitos profundos. Ele produz relaxamento do músculo liso e um amolecimento das fibras de colágeno.
Adicionalmente, a relação dos níveis de estrogênio e progesterona influencia na distensibilidade venosa.
Essa relação pode explicar a predominância dos sintomas de insuficiência venosa no primeiro dia do período menstrual, quando ocorre uma profunda mudança da fase progesterônica para a fase estrogenica do ciclo menstrual.
Aspecto clínico da insuficiência venosa crônica
grave com edema, hiperpigmentação, lipodermatoesclerose
e principalmente as ulcerações que são mais freqüentes na
região do maléolo medial, embora na figura do lado
esquerdo, a ulceração alcançou também a face lateral da
perna direita devido a gravidade da IVC
FORMAS CLÍNICAS
Classicamente, a IVC agrupa quatro formas clínicas:
- as varizes primárias ou essenciais
- a síndrome póstrombótica (SPT)
- as varizes por angiodisplasias congênitas (Síndrome de Klippel-Trenaunay, síndrome de Parkes-Weber, síndrome de Bockenheimer)
- as varizes por fístulas arteriovenosas adquiridas.
- Admite-se, hoje, que as varizes da gravidez constituem, também, um grupo à parte, com características etiopatogênicas e fisiopatológicas próprias.
FISIOPATOLOGIA
Existem dois mecanismos para a hipertensão venosa.
MECANISMO HIDROSTATICO
O primeiro é a pressão hidrostática, relacionado à pressão da coluna de sangue do átrio direito.
Em situações normais, o fluxo venoso corre, do sistema venoso superficial para o profundo, através de veias comunicantes com válvulas competentes, que impedem o retorno de sangue para as veias superficiais. A incompetência das válvulas do sistema venoso profundo e comunicante e o refluxo resultante causam hipertensão venosa
A mais comum causa de IVC é a trombose venosa iliofemoral.
Cerca de 85% dos pacientes com trombose venosa profunda prévia, documentada podem desenvolver úlcera venosa nos próximos 10 anos.
A recanalização das veias trombosadas restaura a perviedade, mas há perda da competência das válvulas no local, que transmitem a alta pressão venosa para segmentos mais distais. Este aumento da pressão transmite-se às veias perfurantes, que após dilatação perde a competência valvular ocasionando fluxo reverso. Esta hipertensão venosa atingindo veias mais distais é transmitida às vênulas e à microcirculação da pele e do tecido celular subcutâneo, através de dois mecanismos intrínsecos: perda do reflexo veno-capilar e alteração da bomba muscular da panturrilha.
A obstrução venosa, em pacientes que tiveram trombose venosa profunda, tende à recanalização em um período de três a seis meses. Após esse processo, ocorre a lesão das cúspides das válvulas venosas pelo processo trombótico e o conseqüente refluxo venoso. Com a presença do refluxo, no início do quadro, a musculatura da panturrilha tenta compensar a sobrecarga de volume das veias insuficientes, ejetando um volume de sangue maior. Com o agravamento do refluxo, a bomba torna-se insuficiente para promover uma redução cíclica da pressão de 100 mmHg para níveis de 0 a 30 mmHg. Instala-se, dessa forma, um quadro de hipertensão venosa crônica permanente, levando aos sinais e sintomas de IVC.
Estas alterações de fluxo sangüíneo causam extravasamento de fluidos e acúmulo pericapilar de depósitos de fibrina (manguitos de fibrina) que alteram o metabolismo entre os compartimentos extra e intravascular. Os capilares encontram-se dilatados, alongados, tortuosos e com as paredes afiladas e o endotélio apresenta superfície irregular e alargamento dos espaços interendoteliais.
MECANISMO DINÂMICO
O segundo mecanismo é dinâmico e está relacionado à musculatura da panturrilha, que exerce papel importante no retorno venoso. Essa bomba muscular, quando em perfeito funcionamento, comprime as veias profundas da panturrilha durante sua contração (os maiores reservatórios desse sistema são os capilares sinusóides soleares e gastrocnêmicos). A válvula distal da veia profunda e as válvulas das veias perfurantes fecham-se, e o sangue é ejetado em direção ao coração. Durante o relaxamento da panturrilha, produz-se uma enorme queda de pressão nas veias profundas, podendo atingir pressões negativas; fecha-se, então, a válvula proximal do eixo profundo. Dessa forma, a pressão venosa da rede superficial torna-se mais elevada do que a dos eixos profundos, e o sangue é aspirado em profundidade através das veias perfurantes.
Assim, por meio de uma ação aspirante e compressora, reduz-se a pressão hidrostática venosa de um indivíduo, de 100 mmHg a valores de 0 a 30 mmHg, durante a deambulação. A bomba muscular, em um indivíduo sadio, ejeta o sangue de modo tão eficaz que reduz a pressão intravascular venosa a valores próximos de zero e é capaz de gerar pressões superiores a 200 mmHg. Para que essa bomba muscular funcione adequadamente, faz-se necessária a presença de veias de drenagem pérvias com válvulas competentes, musculatura eutônica e eutrófica, integridade neural e articulações livres.
A disfunção da bomba muscular da panturrilha, associada ou não à disfunção valvular, também é responsável pela hipertensão venosa, levando a um acúmulo excessivo de líquido e de fibrinogênio no tecido subcutâneo, resultando em edema, lipodermatosclerose e, finalmente, ulceração. A pressão venosa permanece elevada nos membros inferiores durante a deambulação, quando, em condições normais, deveria diminuir. Assim, os tecidos adjacentes são expostos a uma pressão venosa elevada continuamente, enquanto o paciente permanece com as pernas para baixo. Ainda permanece sem explicação por que essa pressão elevada leva à formação de úlceras nos membros inferiores. O edema secundário à hipertensão venosa pode ser um dos fatores. Todavia, pacientes com insuficiência cardíaca e/ou congestão hepática com edema de membros inferiores não desenvolvem as alterações de pele e úlceras características de pacientes com insuficiência venosa crônica.
Duas teorias tentam explicar essas mudanças que ocorrem em pacientes com IVC.
- A primeira argumenta que a pressão venosa elevada causa um aumento do tamanho do leito capilar e o alargamento dos poros intersticiais, permitindo um extravasamento de fibrinogênio através dos poros, o qual se polimeriza em fibrina. O depósito de fibrina leva à formação de manguitos que interferem na difusão de oxigênio e nutrientes, predispondo à formação de úlceras.
- A segunda teoria afirma que os leucócitos seriam seqüestrados na parede endotelial no leito capilar exposto à pressão venosa elevada. Os leucócitos entrariam em contato com moléculas de adesão intracelulares na parede capilar. As células seriam ativadas, e ocorreria liberação de citoquinas e radicais livres no leito venoso, o que levaria a uma reação inflamatória, com lesão das válvulas venosas e do tecido adjacente, predispondo à ulceração.
EDEMA
Pelo prolongado e aumentado extravasamento ocorre alargamento dos espaços pericapilares e edema na camada intersticial, correspondendo ao achado clínico de edema.
PIGMENTAÇÃO
A hemoglobina resultante das hemácias extravasadas e fragmentos de eritrócitos no espaço pericapilar é degradada em hemossiderina que é responsável pela hiperpigmentação.
ULCERAÇÃO
Atualmente aceita-se que a ulceração seja provocada por lesão capilar. Esta lesão ocorre pela adesão de leucócitos às células endoteliais capilares provocando liberação de radicais livres, catabólitos e substâncias vaso-ativas. Há então empilhamento das hemácias e microtromboses nos capilares (VEJA ABAIXO)
Representação esquemática da adesão leucocitária ao endotélio liberando então substâncias inflamatórias. Observe o empilhamento das hemácias.
A estes processos segue-se a formação de tecido de granulação, proliferação de capilares e fibroblastos, e, finalmente, cicatrização da ferida por formação de tecido cicatricial. Clinicamente este processo leva a lipodermatosclerose, atrofia e na forma mais grave, a ulcerações onde os mecanismos compensatórios não são suficientemente capazes de reparar a lesão.
CLASSIFICAÇÃO
A primeira classificação da IVC foi proposta por Widmer e tinha como desvantagens a natureza não específica do estágio I e a ausência da diferenciação entre as alterações tróficas no estágio II. A classificação era a seguinte:
• Classe I – edema, coroa flebectásica paraplantar.
• Classe II – alterações tróficas (hiperpigmentação e lipodermatosclerose).
• Classe III – úlcera aberta ou cicatrizada.Após, surgiu a classificação de Porter:
• Classe 0 – Assintomática.
• Classe 1 – IVC leve. Edema moderado, dor discreta e dilatação local ou generalizada de veias subcutâneas.A classificação mais utilizada atualmente é a chamada CEAP (1994). É mais completa pois aborda, além do critério clínico e anatômico, o etiológico e o fisiopatológico e, através de um sistema de pontuação, classifica a gravidade clínica e a incapacidade para o trabalho. É uma classificação, no entanto, mais complexa e de mais difícil abordagem.
CLASSE
CLINICA (C)
0
Sem sinais de doença venosa visível ou palpável
1
Telangiectasias ou veias reticulares, aumento maleolar
2
Veias varicosas
3
Edema sem alterações da pele
4
Alterações cutâneas (Hiperpigmentação; eczema; dermatofibrose, lipodermatoesclerose)
5
Classe 4 + úlcera curada.
6
Classe 4 + úlcera ativa
Membros nas mais altas categorias acima têm sinais mais graves de doença venosa crónica e podem ter alguns ou todos os achados definindo uma categoria clínica menos grave. Cada membro é também caracterizado como assintomático (A), por exemplo, C(0-6)A, ou sintomático (S), por exemplo, C(0-6)S. Sintomas que podem estar associados a telangiectasias, veias reticulares, ou veias varicosas, incluem dor com diferentes graus de intensidade e irritação da pele no membro inferior. A terapia pode alterar a categoria clínica da doença venosa crónica. Os membros devem, portanto, ser reclassificados após qualquer forma de tratamento clínico ou cirúrgico.
CLASSIFICAÇÃO ETIOLOGICA (E)
Disfunção venosa pode ser congénita, primária, ou secundária. Essas categorias são mutuamente exclusivas.
- Distúrbios venosos congénitos estão presentes ao nascimento, mas podem ser reconhecidos somente mais tarde. O método de diagnóstico das anomalias congénitas deve ser descrito.
- Disfunção venosa primária é definida como uma disfunção de causa desconhecida, mas não é de origem congénita.
- Disfunção venosa secundária denota uma condição adquirida resultando em doença venosa crónica, p. ex., trombose venosa profunda.
CONGENITA
EC
PRIMARIA
EP (CAUSA INDETERMINADA)
SECUNDARIA
ES (POS-TROMBOTICO, POS-TRAUMATICO, OUTROS)
CLASSIFICAÇÃO ANATOMICA
Os sítios anatómicos da doença venosa devem ser descritos como veias superficial (As), profunda (Ao), ou perfurante (Ap). Um, dois ou três sistemas podem ser comprometidos em qualquer combinação. Para estudos que requerem maiores detalhes, o comprometimento das veias superficial, profunda pode ser localizado pelo uso dos segmentos anatomicos
SEGMENTO VEIAS SUPERFICIAIS (As) 1 Telangiectasias/Veias reticulares
2 Safena interna acima do joelho (supra-patelar)
3 Safena interna abaixo do joelho (infra-patelar)
4 Safena externa
5 Não safenas
SEGMENTO VEIAS PROFUNDAS (Ad) 6 Veia cava inferior
7 Veia ilíaca comum
8 Veia ilíaca interna
9 Veia ilíaca externa
10 Pélvis-gonadal, ligamento largo, etc
11 Veia femoral comum
12 Veia femoral profunda
13 Veia femoral superficial
14 Veia femoral poplítea
15 crural-tibial anterior, tibial posterior, peroneira
16 muscular - gastrocnêmio, sóleo
SEGMENTO VEIAS PERFURANTES (Ap) 17 coxa
18 perna/panturrilha
CLASSIFICAÇÃO FISIOPATOLOGICA (F)
REFLUXO FR OBSTRUÇÃO FO REFLUXO E OBSTRUÇÃO FR & FO SINTOMATOLOGIA
São possíveis várias causas de dor no membro inferior que podem coexistir. Entretanto, é necessária a definição précisas dos sintomas de estáse venosa.
Eles podem ter início gradual ou podem começar com uma dor lancinante, e podem preceder o aparecimento clínico das varicosidades. Usualmente ocorre mais desconforto com temperaturas mais elevadas e após ortostatismo prolongado.
Os sintomas relacionados aos veias varicosas são, geralmente, desproporcionais ao grau das alterações patológicas. Pacientes com varizes pequenas e pouco tempo de evolução podem ter mais queixas do que aqueles com varizes calibrosas e crónicas.
A sintomatologia inicial pode variar desde uma pressão pulsátil, ou queimação até uma sensação de peso. A dor é, caracteristicamente, surda. não ocorrendo durante o repouso ou pela manhã, e é exacerbada ao final da tarde, especialmente após longo período em posição ortostática.
As sensações desconfortáveis de dor. peso, cansaço ou queimação são aliviadas por meio de repouso, elevação dos membros ou compressão elástica.
O prurido também é um sintoma de estáse venosa e é, geralmente, um indicador de compressão elástica inadequada. É uma manifestação de congestão local que precede o inicio da dermatite. Este e quase todos os sintomas de estáse podem ser explicados pela irritação das fibras dos nervos superficiais, por compressão local ou acúmulo de produtos metabólicos finais, com consequente mudança do pH.
Pode ocorrer hemorragia externa, quando uma veia superficial pressiona a péle vizinha dentro do seu invólucro protetor.
DIAGNÓSTICO
Observação clínica
O diagnóstico da IVC com edema, induração, hiperpigmentação e ulceração é freqüentemente feito através da história clínica e do exame físico.
O exame físico, embora, revele a presença da IVC, não é suficiente para localizar e quantificar os defeitos funcionais e anatômicos. Para a adequada caracterização e conduta torna-se necessária a utilização de exames subsidiários.
TVP do membro inferior
Existe um estágio pré-edematoso como também, um estágio edematoso:
1) ESTADO PREEDEMATOSO
Sinais gerais:
- febre ou subfebrilidade (resistente ao antibioticos mas reagente ao anticoagulantes)
- pulso Mahler, taquicardia
- sinal do Leger ansiedade - provavelmente, sendo acompanhada com microembolias cerebrais
Sinais locais:
A) DOR:
- espontanea - alojada ao longo do conjunto vasculo-nervoso, inicialmente discreta (sensação de peso), depois de intensidade gradualmente aumentativa, as vezes tipo uma câimbra, acentuada ao andar, do lado interno da sola, no calcanear ou ao nivel da inserção do tendão do Aquiles
- provocada - apalpação digital da região mediana dasola, e ao compressão da moleta sobre a membrana interossea.
- acentuada de manobras diagnosticas: sinal do HOMANS (flexão dorsal do pe sobre a gamba), ao inflar a manga do aparelho de pressçao ate 150 milímetros Hg, andar rapido,
B) IMPOTENCIA FUNCIONAL PROGRESSIVA
C) CIRCULAÇÃO COLATERAL (vizualização das veias "sentinela" do PRATT), veias superficiais que atravessam a tibia)
D) HIDROFILIA TISULAR
E) CORDÃO VERMELHO E DOLORIDO OU SIMPLESMENTE CONSISTÊNCIA PASTOSA LOCAL
2) ESTADO EDEMATOSO
- a dor intensifica-se, sendo associada com formigamento do inteiro membro (diminui quando a gamba esta em hemiflexão e rotação externa, sendo o pé em extensão sobre a gamba)
- a impotencia funcional e marcada
- o edema e volumoso
- "FLEGMASIA ALBA DOLENS" mais circulação venosa colateral
- "FLEGMASIA CERULEA DOLENS" pele cianotica, sendo associado o espasme arterial
- corão duro superficial, as vezes
- adenopatia inguinal
Exames subsidiários:
AVALIAÇÃO DIAGNOSTICA DA DISFUNÇÃO VENOSA
O mais importante de todos os exames não-invasivos disponíveis para estudar o sistema venoso é o exame físico, associado a uma história cuidadosa que elucide os sintomas mencionados acima.
O exame físico com boa iluminação proporciona quase todas as informações necessárias para o diagnóstico.
Ele determina a natureza da estáse venosa e averigua a presença de manchas venosas e varicosidades protuberantes, a localização dos principais pontos de inspeção ou veias perfurantes que alimentam grupos de varicosidades, a localização e a extensão de hiperpigmentação e a gravidade de nodulos subcutâneos. Após a obtenção dos dados, o médico parte para exames não-invasivos que irão corroborar o seu diagnóstico. O exame visual pode ser suplementado com a avaliação de um impulso descendente durante a tosse. A percussão da coluna venosa de sangue também demonstra a transmissão da pressão através da coluna estática para veias distais incompetentes.
O exame de Perthes, para oclusão das veias profundas, e o exame Brodie-Trendelenburg para o refluxo axial foram substituídos, no consultório, pelo aparelho de Doppler portátil com ondas contínuas complementado pela avaliação com duplex scan.
Os exames subsidiários solicitados para a confirmação diagnóstica e quantificação da hipertensão venosa, são divididos em testes não-invasivos e invasivos.
A IVC pode ser resultado de obstrução do fluxo venoso, refluxo ou a combinação de ambos fatores, deste modo, o objetivo da realização dos exames não-invasivos é a detecção de obstrução ou refluxo e, se possível, a localização anatômica da anormalidade.Os não invasivos utilizados são:
- sonar de efeito Doppler portátil: Exame facilmente realizável que complementa o exame físico e serve como triagem para pacientes ambulatoriais. Nos aparelhos de efeito Doppler que possuem onda contínua podemos obter informações importantes sobre o refluxo venoso nas junções safenofemoral e safenopoplítea. Em mãos experientes, estas informações levam ao diagnóstico em 90% dos pacientes. Na região poplítea e para localização de veias perfurantes insuficiêntes, este exame, entretanto, não é acurado.
O aparelho de Doppler portátil pode confirmar a impressão de refluxo na safena, indicando, assim, a necesidade de um procedimento cirúrgico a ser realizado no referido paciente. Um conceito errado é a crença de que o aparelho de Doppler é utilizado para localizar veias perfurantes. Em vez disto, ele é usado em localizações específicas para determinar válvulas incompetentes (p. ex., o aparelho portátil de ondas contínuas com detector de fluxo de 8 MHz colocado sobre as is safena interna ou externa, próximo as suas terminações).
Identificação acurada do refluxo valvular é conseguida com aumento e liberação do fluxo distal, durante a respiração normal. e com o uso da manobra de Valsalva. Normalmente, o exame com Doppler é complementado por outros estudos objetivos. Estes incluem a fotoplestimografia, a plestimografia com mercúrio e a fotorreografia, mas eles não são utilizados atualmente.- Mapeamento Dúplex (MD) ou Eco-Doppler suplementa o exame físico e a avaliação através do Doppler portátil de onda contínua. O MD fornece informações sobre o fluxo e mesmo refluxo em veias específicas, isto é, femoral, poplítea, veias profundas da panturrilha e veias perfurantes. Por meio de manobras de compressão pode-se documentar o refluxo venoso e o fechamento das válvulas, possibilitando o diagnóstico preciso. O uso do MD colorido tem possibilitado uma avaliação mais rápida e mais acurada.
- fotopletismografia venosa é um exame que mede a variação do volume do membro através do enchimento venoso, por meio de uma célula fotoelétrica colocada na pele da região que se pretende estudar. Com este exame, obtém-se a análise não-invasiva do tempo de reenchimento venoso, e com isto a incompetência do sistema venoso superficial ou profundo. São técnicas que proporcionam uma seleção inicial dos pacientes.
- outro instrumento reintroduzido para avaliar a função fisiológica da bomba muscular e das válvulas venosas é a pletismografia com ar. Ela foi descartada nos anos de 1960, devido a sua natureza incómoda. A computação permitiu sua reintrodução. O instrumento consiste em uma câmara de ar que envolve o membro inferior desde o joelho até o tornozelo. Durante a calibração, as veias são esvaziadas através da elevação do membro, então o paciente é colocado de pé para que o volume venoso do membro possa ser medido, assim como seu tipo de enchimento. A taxa de enchimento é expressa em milimetros por segundo, oferecendo medidas semelhantes às técnica com mercúrio.
- A tecnologia do duplex scan define mais precisamente quais veias têm refluxo pela visualização das veias superficiais e profundas.
O exame é normalmente realizado com o paciente em posição supina, porém isso permite uma avaliação errònea do refluxo. Na posição supina, mesmo quando não fluxo, as válvulas permanecem abertas. O fechamento valvular necessita de um fluxo reverso, em que o gradiente de pressão seja maior proximalmente do que medialmente. Portanto, o exame com duplex scan deve ser realizado com o paciente em posição ortostática, ou com o tronco bastante elevado.
As imagens são obtidas com transdutor de 7,0 ou 7,5 MHz, e o Doppler pulsado consiste em um transdutor de 3,0 MHz. O paciente é colocado de pé, com o transdutor posto longitudinalmente na região inguinal. Após a realização das imagens, os volumes podem ser medidos tanto na veia safena quanto na femoral. Este fluxo pode ser observado com o seu aumento distal ou durante o repouso com a respiração normal. A liberação súbita deste aumento permite a avaliação da competência valvular. A veia safena externa e a veia poplítea são examinadas de forma similar. As imagens melhoram a acurácia do exame com Doppler. Por exemplo, a incompetência da veia safena externa pode ser diferenciada da incompetência valvular das veias gastrocnêmias pela aquisição de imagens e detecção do fluxo com duplex ou triplex scan.
A difusão do uso do duplex scan tem permitido a comparação entre os achados do exame clínico-padrão e os estudos com duplex scan.Os testes invasivos utilizados são:
- medida da Pressão Venosa Ambulatorial Direta: A determinação da pressão venosa ambulatorial é de grande auxílio para o diagnóstico da IVC e serve também para o seguimento dos procedimentos reconstrutivos do sistema venoso profundo, embora seja invasivo e moderadamente complexo na sua execução. Cateteriza-se veia dorsal do pé e obtém-se as pressões venosas em posição supina de repouso, em posição ortostática e após o exercício. Em pacientes com IVC sem obstrução, a pressão venosa em posição supina é normal. Em pé, o aumento da pressão venosa ocorre mais rapidamente do que o tempo de enchimento normal. A linha de base em posição em pé é normal e com o exercício a queda da pressão geralmente não alcança 50% do nível basal.
- flebografia do membro inferior que é considerada o padrão-ouro para o diagnóstico da IVC e, a associação da flebografia ascendente à descendente permite o diagnóstico anatômico das lesões valvulares e quantificação da hipertensão venosa. Além disto, ainda hoje são exames fundamentais para a absoluta indicação do tratamento cirúrgico da IVC.
- A flebografia ascendente é realizada com o paciente em decúbito dorsal horizontal ou a 60º e injeta-se uma substância de contraste no sistema venoso por meio de punção de veia dorsal do pé com garroteamento distal do tornozelo. Neste exame é importante observar-se a perviedade do sistema venoso profundo, as obstruções venosas, as dilatações das veias, a circulação colateral e a presença das válvulas venosas.
- Já na flebografia descendente, a substância de contraste é injetada por meio de cateter colocado na veia femoral ou por meio de punção simples desta veia. Acompanha-se a progressão retrógrada da substância de contraste, utilizando a manobra de Valsalva e em casos graves de IVC, pode-se verificar o refluxo da substância de contraste atingindo as veias do tornozelo. A flebografia descendente analisa fundamentalmente a competência do sistema valvular das veias profundas.
Geralmente, a flebografia é desnecessária no diagnóstico e tratamento da estáse venosa primária e das veias varicosas. Mas em problemas complexos de IVC grave, a flebografia pode ser especificamente útil. A flebografia ascendente define obstruções. A flebografia descendente identifica incompetências valvulares específicas, suspeitadas ao ultra-som modo-B e ao exame clínicoDiagnostico diferencial
Quanto ao diagnóstico diferencial dos edemas dos MMII, várias doenças podem ser confundidas com a IVC:
EDEMA AGUDO
UNILATERAL
BILATERAL
DIAGNOSTICO
TVP
ICC, nefropatia, hepatopatia
CLINICA
edema doloroso, mole, liso e cianose
edema indolor, mole e liso
EXAMES
mapeamento dúplex, flebografia
estado cardiopulmonar ou perfil renal e hepático
EDEMA CRONICO BILATERAL BILATERAL UNILATERAL UNILATERAL DIAGNOSTICO LIPEDEMA LINFEDEMA PRIMARIO ISQUEMICO I. V. C. Sinais clinicos edema mole e muito doloroso , colar gordura
no joelho em mulheresedema duro em perna, dorso do pé e
artelhosedema mole, muito doloroso, até o pé, com
lesões necróticasedema liso, mole,
pigmentação, atrofia branca,
dermatosclerose e
úlcera.Exames sem testes linfocintilografia Doppler arterial índice
tornozelo/ braçomapeamento dúplex e fotopletismografia
venosaTRATAMENTO
Tratamento clínico
O pilar terapêutico da IVC é o tratamento clínico, que baseia-se em medidas gerais e farmacológicas. Como a doença venosa é crônica e insidiosa, causando permanente dano e invalidez durante anos, é necessário a correta orientação em relação às medidas gerais higieno-dietéticas:
a) tratar a obesidade mediante dieta hipocalórica, indicar restrição de líquidos, de sal e alcoól;
b) exercício físico moderado (natação, bicicleta, caminhadas);
c) tratamento das doenças associadas;
d) evitar calor ambiental ou fontes diretas de calor, sobretudo quando acompanhadas de ortostatismo ou posição sentada prolongados;
e) controle da circulação de retorno durante a gestação;
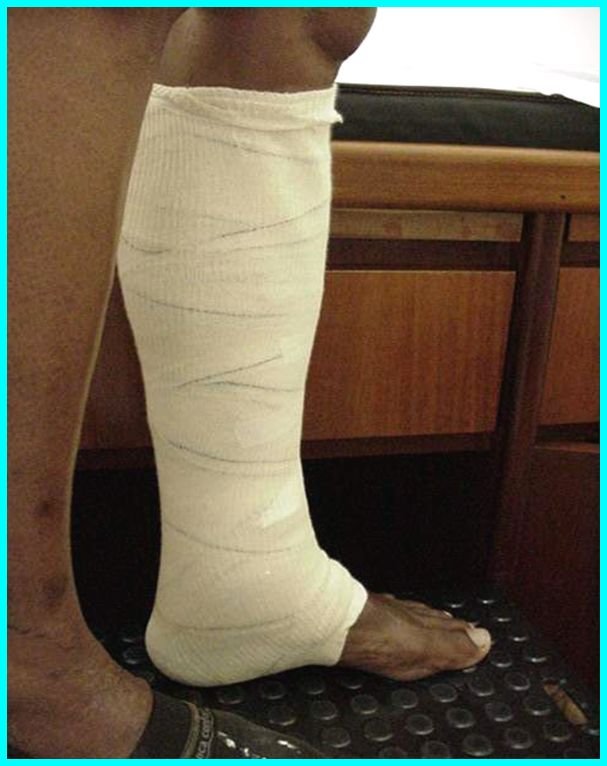
f) utilização de suporte elástico. O suporte elástico graduado é uma necessidade por toda a vida para a maioria dos pacientes.
Até o momento, as meias elásticas de compressão graduada são as indicadas e fornecem um suporte adequado. A aderência meticulosa dos pacientes ao uso das meias elásticas de compressão graduada previne as conseqüências tardias da hipertensão venosa crônica e aliviam os sintomas e os sinais. As meias elásticas até os joelhos são usualmente suficientes pois a ação muscular no retorno venoso ocorre fundamentalmente na região das panturrilhas. As meias elásticas que produzem uma compressão de 30-40 milímetros Hg ao nível do tornozelo são muito efetivas na redução do edema e dos outros sinais de IVC.
O principal ponto no tratamento dos pacientes com IVC é a compressão externa, e a maioria dos pacientes é tratada conservadoramente. Os pacientes com IVC possuem edema dos membros inferiores como parte de seu quadro clínico. A compressão ao aliviar o edema geralmente controla a IVC. Entretanto, o mecanismo pelo qual a compressão é benéfica não está completamente entendido, e alterações fisiológicas foram observadas com a compressão. Estas incluem redução da pressão venosa, melhora na microcirculação da pele e aumento da pressão subcutânea, a qual antagoniza o extravasamento transcapilar de fluidos. A maioria dos pacientes com IVC e aqueles com úlcera venosa são tratados com cuidados locais da lesão e compressão elástica.
As úlceras venosas são tratadas conservadoramente com:
- elevação dos MMII,
- terapia compressiva
- a Bota de Unna.
Tratamento da úlcera
A cicatrização da úlcera é feita em três fases histológicas, descritas como: inflamatória, proliferativa e de remodelação cicatricial. A maioria das feridas tem sua lesão fechada em 30 dias quando se trata da etiopatogenia e das complicações com curativos simples compressivos e com cuidados de higiene.
Em alguns doentes, apesar dessa terapêutica básica, a lesão evolui cronicamente, às vezes, arrastando-se por mais de um ano. O curativo fechado mantém o ambiente úmido, o que evita a formação de crosta e aumenta a velocidade da migração das células epiteliais, da síntese de colágeno, da formação do tecido de granulação e da angiogênese.
Além disso, esses curativos mantêm um exsudato da ferida rico em fatores de crescimento, que aceleram os processos cicatriciais. As bandagens elásticas e inelásticas são efetivas.
O dermatologista alemão Paul Unna, em 1885, introduziu o uso de uma pasta à base de óxido de zinco associado à compressão elástica para tratamento da úlcera varicosa, que é empregado até os dias de hoje. O mecanismo de ação da bota de Unna funciona tanto através da compressão elástica, permitindo que o paciente deambule, como através de ação tópica.
Vários curativos foram lançados nos últimos anos, desde modificações dos tradicionais curativos fechados em pasta de Unna, gaze e esponjas absorventes com medicamentos impregnados até novos produtos com base em hidrocolóides, aglomerados de fibras de alginato ou carvão ativado. Além de manter o ambiente da lesão apropriado, controlam sua hidratação, absorvem o excesso de secreção e evitam a maceração das bordas das feridas. Atualmente, existem os chamados curativos bioativos, obtidos por engenharia genética e que atuam especificamente em uma ou mais fases da cicatrização.
Também estão sendo utilizados os equivalentes à pele humana, formados por uma matriz protética de bovino preenchida por queratinócitos e fibroblastos humanos.
A pentoxifilina, um agente hemorreológico, atua na prevenção da ativação dos leucócitos e na liberação de radicais livres, aumentando o aporte de oxigênio aos tecidos. Essa droga deve ser usada como tratamento coadjuvante em associação com a compressão elástica.
Em pacientes com úlcera ativa, as evidências da eficácia da medicação ainda são limitadas. O diagnóstico bacteriológico e o uso de antibióticos rotineiramente não são recomendados, uma vez que não apresentam influência no diagnóstico, no tratamento e no prognóstico. Ressalva-se o uso de antibióticos nos casos de infecções com manifestações sistêmicas. O valor do uso dos diversos tipos de tratamento local ainda não foi comprovado, sendo contra-indicado o uso de antibióticos tópicos.
Os pacientes portadores de úlceras venosas ativas e refluxo em junção safeno-femoral ou safeno-poplítea beneficiam-se com o tratamento cirúrgico.
Embora a não adesão ao tratamento clínico seja a causa mais comum da não cicatrização da úlcera, outras causas devem ser excluídas, principalmente a insuficiência arterial.
As infecções fúngicas e bacterianas devem ser tratadas adequadamente e, em alguns casos, uma biópsia deve ser realizada para a exclusão de carcinoma basocelular ou escamoso.
BOTA DE UNNA
Uma atadura com três camadas, compressiva, empastada com óxido de zinco, que ficará em contato com a pele, é utilizada desde a base dos dedos até a tuberosidade tibial anterior, com uma compressão firme e graduada.
Essa interação é conhecida, mais comumente, como "bota de Unna". Uma revisão recente, de 15 anos com 998 vítimas de uma ou mais úlceras venosas, tratadas com uma bandagem similar, demonstrou que 73% das úlceras cicatrizaram nos pacientes que retornavam para tratamento. O tempo médio de tratamento para úlceras únicas foi de nove semanas. Em geral, as ataduras descritas acima promovem uma cicatrização mais rápida, do que somente o uso de meias elásticas.
Para a maioria dos pacientes, a compressão bem aplicada e mantida oferece o tratamento com o menor custo e maior eficiência para a cicatrização das úlceras venosas. Após a cicatrização, a maioria dos casos de FVC é controlada com meias elásticas, usadas durante o período de deambulação.
Ocasionalmente, em pacientes muito idosos ou com problemas de artrose que não podem usar as meias elásticas, o controle pode ser obtido com a bota de Unna, que pode ser mantida por uma semana.
Utiliza-se antibioticoterapia somente em pacientes com contaminação bacteriana comprovada e após isolamento da bactéria predominante na lesão. O eczema varicoso e a dermatite de estáse são tratados com soluções apropriadas de lanolina e preparações com corticosteróides de uso tópico. Tem sido indicado mais recentemente a utilização de drogas que agem na microcirculação facilitando a cicatrização destas lesões.
Do ponto de vista farmacológico, o tratamento da IVC visa aliviar as manifestações clínicas e evitar ou controlar as complicações. Utilizam-se em linhas gerais os cardiotônicos, diuréticos, os flavonóides hidrosolúveis e sais cálcicos.
Tratamento cirúrgico
As principais indicações para o tratamento cirúrgico são pacientes que não melhoraram com a terapia clínica ou que desenvolveram complicações recorrentes (celulite, úlceras infectadas ou tromboses).
Consegue-se obter bons resultados em pacientes selecionados, incapazes de manter o tratamento clínico e principalmente jovens em idade produtiva.
1. ESCLEROTERAPIA
As venectasias com menos de 1 milímetros de diâmetro não necessitam de tratamento cirúrgico. Caso sejam decorrentes de incompetência da safena ou suas tributárias, elas poderão ser tratadas cirurgicamente. As venectasias podem ser tratadas de maneira eficiente com modernas técnicas de escleroterapia. Soluções diluídas de esclerosante (p. ex., tetradecil sódico a 0,2%) podem ser injetadas diretamente nos vasos da área acometida. Deve-se ter cuidado para que a dose não ultrapasse 0,1 ml em cada injeção, mas várias injeções enchem completamente os vasos de determinada área. Quando todos os vasos de determinada área tiverem sido preenchidos com o esclerosante, e antes que a reação inflamatória subjacente tenha progredido, uma atadura elástica é aplicada para evitar o retorno do sangue por 24 a 72 horas. Após 14 a 21 dias, é realizada uma incisão com drenagem do sangue retido e nova compressão por 12 a 18 horas. A liberação do sangue retido é fundamental para o sucesso da injeção primária. Essa terapia é reconhecidamente bem-sucedida por alcançar excelentes resultados estéticos e alívio dos sintomas.
Em pacientes alérgicos, a opção é o uso da solução salina hipertônica. Por outro lado, o uso de novas tecnologias, como o tratamento das telangiectasias com laser, mostrou-se desapontador. Vênulas maiores que 1 milímetro e menores do que 3 milímetros também podem ser esclerosadas, com uma concentração maior da substância para esclerose (tetradecil sodico 0,5%), porém limitando-se o volume injetado para maximo 0,5 ml. As faixas elásticas devem ser mantidas por pelo menos 72 horas. O esvaziamento do sangue retido é de fundamental importância para prevenir a recanalização desses vasos após o tratamento.
2. SAFENECTOMIA
O tratamento cirúrgico pode ser usado para remover grupôs de varicosidades com diâmetro maior que 4 milímetros.
A flebectomia ambulatorial pode ser realizada usando pequenas incisões (somente com a ponta do bisturi, como uma facada), com preservação das veias safenas interna e externa, caso elas não forem afetadas pela incompetência valvular.
Quando a incompetência está presente nas veias safenas interna e externa, a remoção dos grupos é precedida pela remoção limitada da veia safena (safenectomia) As tecnicas para safenectomia são mais bem aplicadas de cima para baixo, para evitar danos em linfáticos e nervos. Têm sido descritas muitas técnicas que adaptam novos instrumentos minimamente invasivos para a remoção da veia safena.
No momento atual, como a veia safena interna é retirada para confecção de ponte coronariana e revascularização periferica, tem havido interesse em preservar a veia safena durante o procedimento para alívio dos sintomas da insuficiência venosa, com poucas evidências que justifiquem sua retirada. Entretanto, vários estudos têm demonstrado a vantagem da retirada na prevenção de recorrência de veias varicosas.A questão quanto à preservação ou à retirada da veia safena e importante, foi realizado um acompanhamento por cinco anos com exame clínico e duplex scan de um grupo de pacientes. Os pacientes foram randomizados em grupos para retirada da veia safena durante operação de varizes versus a ligadura da junção safeno-femoral, com incisões e exerese das varizes. Foi visto que as reoperações, realizadas e a serem realizadas, foram necessárias somente para três de 52 membros, que foram safenectomizados versus 12 cm em 58 membros, nos quais foram realizadas ligaduras próximas. O problema de neovascularização foi a causa de recidiva da incompetência safeno-femoral em 12 de 52 membros em que tinha sido feito o arrancamento da safena, versus 30 de 58 membros nos quais havia sido feita apenas ligadura. Claramente, o problema de neovascularização e recidiva de veias varicosas não foi resolvido pelo arrancamento, mas o arrancamento diminuiu o risco de reinfecção de dois terços após 3 anos de observação. Os autores do estudo concluíram que a safenectomia "deve ser rotineira para varizes primárias de safena interna".
O tratamento moderno das veias varicosas é fundamentado no princípio da ablação da fonte de refluxo, algumas vezes denominado ponto de escape. Na maioria dos casos, esse ponto é a válvula incompetente da junção safeno-femoral. Esta claro para aqueles que estudam essa doença que, se a fonte e o problema anatómico do refluxo não forem resolvidos, procedimentos secundários, como a escleroterapia, estão destinados a uma alta taxa de recorrência. Por essa razão, o preceito fundamental no tratamento da insuficiência venosa superficial é tratar o ponto de escape para, então, tratar as varicosidades secundárias. Foi recentemente adicionado ao arsenal para tratamento das veias varicosas a ablação por radiofreqüência da veia safena. Esse método de tratamento utiliza um transdutor ultra-sônico de radiofreqüência para ocluir, por via endoluminal, a veia safena através de sua extensão, assim como a sua junção. As informações preliminares sugerem que ele pode ser tão efetivo quanto a ligadura ou safenectomia, a curto e médio prazos. Entretanto, essa modalidade não tem sido aceita universalmente como equivalente nos resultados ou com melhores custos.
CIRURGIA PARA INSUFICIÊNCIA VENOSA CRÓNICA GRAVE
O que há de novo no tratamento da estáse venosa são rearranjos e modificações de métodos antigos. O que não tem mudado é o tratamento conservador da IVC, que sempre precede as considerações sobre intervenções. Esse tratamento recai sobre a compressão do membro combatendo os efeitos da hipertensão venosa.
Enquanto a terapia conservadora está sendo realizada, ou a cicatrização de uma úlcera está em andamento, estudos diagnósticos apropriados devem revelar padrões de refluxo venoso ou segmentos de oclusão venosa, para que a terapêutica específica possa ser indicada para um membro em avaliação. As imagens pelo duplex scan são eficazes na detecção de refluxo, se for realizado por um profissional competente. Este exame não-invasivo pode provar ser o único procedimento necessário, além do Doppler portátil por onda contínua, se a ressecção de veias superficiais for contemplada.
Se a reconstrução venosa direta pela confecção de uma ponte ou valvuloplastia for planejada, é necessária uma flebografia ascendente e descendente.
Surpreendentemente, este refluxo superficial pode ser a única anormalidade presente na estáse venosa crónica avançada. O tratamento percorre um longo caminho em direção ao alivio permanente da disfunção venosa crónica e seus efeitos cutâneos.
Usando a tecnologia do duplex scan, Hanrahan e colaboradores descobriram que em 95 membros com ulceração venosa ativa, 16,8% tinham somente incompetência superficial, e outros 19% apresentavam incompetência superficial combinada com incompetência de perfurantes. De maneira similar, o grupo da Middlesex, em um estudo com 118 membros, verificou que "em mais da metade dos pacientes com ulceração venosa a doença está confinada ao sistema venoso superficial."
Walsh e associados estudaram 58 membros com insuficiência venosa classe 3. Dez membros (17%) exibiram somente refluxo superficial e este era o principal contribuinte para a disfunção superficial crónica em outros 17 membros. É importante o fato de a incompetência primária, profunda, não-trombótica (veias femoral superficial e poplítea) poder acompanhar o refluxo superficial. Isso é explicado pelo refluxo progredindo distalmente na veia safena interna e sobrecarregando o sistema venoso profundo. Pode-se presumir que isso cause a dilatação e o alongamento dos vasos profundos, pois suas válvulas se tornam incompetentes. Um estudo, no qual foi realizada safenectomia em pacientes com incompetência das veias femoral superficial e poplítea, revelou que a correção do refluxo profundo ocorreu após a safenectomia, na maioria dos membros. Claramente, uma proporção significativa de pacientes com úlceras venosas possui função normal das veias profundas, e o tratamento cirúrgico é uma opção útil, que pode corrigir definitivamente as alterações hemodinâmicas. Afirmar que todas as úlceras venosas não são tratáveis cirurgícamente não é razoável, quando essas informações sugerem que a operação nas veias superficiais possui potencial para aliviar a hipertensão venosa.
No início da década de 1940, Linton enfatizava a importância das veias perfurantes e defendia a interrupção cirúrgica direta destas. Mas o procedimento não foi aprovado devido a uma alta incidência pós-operatória de complicações na cicatrização das feridas.
Entretanto, técnicas utilizando vídeo, que permitem visualização direta através de incisões de tamanho pequeno, transformaram a exploração endoscópica subfascial e a ligadura das veias perfurantes como uma alternativa à técnica de Linton, minimizando a morbidade e as complicações da ferida. O tecido conjuntivo entre a faseia crural e os músculos flexores é tão frouxo, que este espaço potencial pode ser facilmente aberto e dissecado com o endoscópio. A operação feita com uma incisão próxima! vertical alcança o objetivo de interromper as veias perfurantes em paciente ambulatorial.
A possibilidade da cirurgia endoscópica subfascial das veias perfurantes teve impacto no tratamento das úlceras venosas, nos países ocidentais, embora não tenha conseguido o impacto esperado por seus proponentes. À medida que os pacientes com IVC grave foram cuidadosamente estudados, a síndrome pós-trombótica teve de dar lugar ao termo insuficiência venosa crónica, e uma conexão com os agregados de plaquetas e monócitos refletiu um infiltrado leucocitário na pele do tornozelo com lipodermatoesclerose e ulceração em atividade e cicatrizadas.
As informações sobre os leucócitos na IVC são númerosos e consistentes, e a ativação dos leucócitos sequestrados m microcirculação cutânea durante a estáse venosa é importante para o desenvolvimento das alterações de pele na IVC. Isso é refletido nos achados de marcadores de adesão entre os leucócitos e células endoteliais, com produção aumentada de enzimas de granulação nos leucócitos, e radicais livres de oxigénio. Entretanto, evidências experimentais ainda necessárias para provar definitivamente a hipótese sobre os leucócitos.
Nos Estados Unidos, vários grupos realizaram a ligatura das veias perfurantes, utilizando aparelho de laparoscopia. As informações iniciais sugerem que a interrupção das veias perfurantes produz rápida cicatrização da úlcera e uma taxa baixa de recorrência. O North American Registry, que arquiva voluntariamente os resultados das operações das veias perfurantes, confirmou uma taxa baixa de recorrência das ulceras em dois anos, e uma cicatrização mais rápida.
Uma comparação entre os três métodos de ligadura das veias perfurantes, incluindo o procedimento clássico do Linton, o procedimento com aparelho de laparoscopia e, finalmente, o procedimento de escopia aberta simples revelaram que as técnicas endoscópicas têm resultados comparáveis com os da operação de Linton, com muito menos cicatrizes e uma tendência muito maior à rápida recuperação. Mais veias perfurantes são identificadas com a técnica aberta. Entretanto, a média de internação hospitalar e o período de cm-valescença são mais favoráveis com os procedimentos laparoscópicos.
Em geral, os registros dos resultados e da experiência clinica individual institucional mostraram que pacientes com síndrome pós-trombótica não se beneficiam com o procedimento o suficiente para que, em Leicester (Inglaterra) estudantes do procedimento afirmassem: "Nós concluimos que a cirurgia das veias perfurantes não é indicada para o tratamento de ulceração venosa em membros com incompetência venosa profunda primaria". No entanto, estudos foram relatados, nos quais o refluxo superficial prévio foi corrigido com a falência desse tipo de tratamento. A melhora de tais membros, com ligadura de veia perfurante produziu resultados satisfatórios e demonstrou que as veias perfurantes são importantes na génese da ulceração venosa e que sua ligadura acelera a cicatrização e pode reduzir a recorrência da ulceração.
Parte da dificuldade em entender a necessidade da ligadura da veia perfurante é a disparidade entre hemodinâmica venosa e a gravidade das alterações cutâneas. Isso não deve ser surpreendente, porque as alterações cutâneas da IVC são dependentes das interações leucócito-endoteliais, o que pode não ser diretamente relacionado à hemodinâmica venosa. A ligadura endoscópica da veia perfurante já tem melhorado a hemodinâmica venosa em alguns membros, conforme o esperado, devido à remoção do refluxo superficial e do fluxo da veia perfurante.
RECONSTRUÇÃO
Historicamente, os primeiros procedimentos com sucesso para reconstrução de veias de grande calibre foram os enxertos fêmoro-femorais cruzados de Eduardo Palma e a interposição safeno-poplítea descrita por ele e usada por Richard Warren, de Boston. Essas operações eram elegantes por sua simplicidade, uso de tecido autógeno e reconstrução por uma anastomose veno-venosa simples.
Em relação ao enxerto fêmoro-femoral cruzado, o único grupo que realizou estudos fisiológicos a longo prazo com um número grande de pacientes foi Halliday e colaboradores de Sidnei, Austrália. Apesar de a flebografia ter sido usada na seleção de pacientes para a operação, não foram dados outros detalhes das indicações pré-operatórias. Eles foram capazes de documentar que 34 de 50 enxertos permaneceram pérvios a longo prazo, como verificado por flebografia pós-operatória. Acreditavam que os melhores resultados clínicos eram alcançados com o alívio da dor na panturrilha após exercício, mas tinham a impressão de que um enxerto funcionante também diminuía a progressão da lipoesclerose distal e controlava a recidiva das úlceras. Nenhuma prova disso foi dada nesse relato. A história do uso dos procedimentos de derivação para obstrução venosa é fascinante. No entanto, o advento das técnicas endovasculares tornou essas operações quase obsoletas.
A ligadura das perfurantes, com a ressecção venosa superficial, tem sido efetiva no controle da ulceração venosa em 75% a 85% dos pacientes. Entretanto, a ênfase em suas falhas levou Kistner em direção à reconstrução venosa direta, com a valvuloplastia, em 1968, e o reconhecimento geral desse procedimento após 1975. Avaliações posteriores da reconstrução valvular direta indicam bons ou excelentes resultados em mais de 80% dos pacientes a longo prazo.
Não se pode superestimar as contribuições de Kistner. A técnica de direcionamento do fluxo venoso incompetente, através de uma válvula proximal competente com a transferência de um segmento venoso, foi sua conquista seguinte. Após as contribuições de Kistner, os cirurgiões foram providos com um arsenal que incluiu a derivação venosa de Palma, a valvuloplastia direta (Kistner) e a transferência de segmento venoso (Kistner). Além disso, a reconstrução valvular externa foi realizada por várias técnicas, incluindo a monitorização por endoscopia, e trouxe a promessa de renovação no interesse dessa forma de tratamento da insuficiência venosa.
O autotransplante axilar para poplítea de segmentos venosos contendo válvulas tem sido considerado desde as primeiras observações de Taheri e colaboradores. A verificação de alguns resultados preliminares excelentes a longo prazo não tem sido consumada.
Com o advento da cirurgia das veias perfurantes os bons resultados conseguidos colocaram a valvuloplastia direta em uma posição menos importante, e ainda com menos interesse do que o procedimento teve durante os anos de 1980.TROMBOSE VENOSA PROFUNDA
A trombose venosa profunda (TVP) aguda é uma grande causa de morbidade e mortalidade nos pacientes hospitalizados, particularmente no paciente cirúrgico.
A tríade de estáse venosa, lesão endotelial e hipercoagulabilidade, descrita pela primeira vez por Virchow em 1856, mantém-se verdadeira um século e meio depois.
A TVP aguda causa vários riscos e tem consequências mórbidas significativas. O processo trombótico iniciado em um segmento venoso pode, na ausência de anticoagulação, ou na presença de anticoagulação inadequada, propagar-se envolvendo segmentos mais proximais do sistema venoso profundo, resultando em edema, dor e imobilidade.
A complicação mais temida da TVP aguda é embolia pulmonar, uma condição com consequências potencialmente letais. A complicação tardia da TVP, particularmente das veias iliofemorais, pode ser IVC decorrente de disfunção valvular na presença de obstrução luminar.
Por essas razões, o entendimento da fisiopatologia, padronização de protocolos para prevenção ou redução da TVP e instituição imediata de tratamento correto são todos essenciais na diminuição da incidência de morbidade dessa condição comum e desafortunada.
ETIOLOGIA
A tríade de estáse venosa, lesão endotelial e hipercoagulabilidade está presente na maioria dos pacientes cirúrgicos. Também está claro que o aumento da idade coloca o paciente sob um risco mais acentuado, sendo os pacientes com mais de 65 anos de idade os representantes da população de grande risco.
Estase
Estudos com fibrinogênio marcado em pacientes, assim como estudos de necropsias têm demonstrado, de maneira bastante convincente, que os seios soleares são o local mais comum para o início da trombose venosa. A estáse pode contribuir com o contato da camada celular endotelial com plaquetas ativadas e fatores prócoagulantes, portanto levando a TVP. A estáse, por si só, nunca foi demonstrada como sendo um fator causal de TVP.
Estado de Hipercoagulabilidade
Nosso conhecimento das condições de hipercoagulabilidade continua melhorando, porém ainda é embrionário. A disposição-padrão de condições selecionadas para quando se procura por estado de hipercoagulabilidade é a seguinte:
- Mutação do fator V de Leiden
- Mutação do gene da protrombina
- Deficiência de proteína C
- Deficiência de proteína S
- Deficiência de antitrombina III
- Homocisteína
- Síndrome antifosfolipídica
Tendo alguma das condições identificada, é instituído um regime terapêutico de anticoagulação por toda vida, a menos que existam contra-indicações específicas.
É, geralmente, apreciado que um paciente em pós-operatório de operações de grande porte está predisposto à formação de TVP. Após operações de grande porte, grandes quantidades de fator tecidual podem ser liberadas dentro da corrente sanguínea, provenientes dos tecidos lesionados. O fator tecidual é um potente pró-coagulante expresso na superfície celular dos leucócitos, como também sua forma solúvel na corrente sanguínea. Aumento na contagem de plaquetas, adesividade, alterações na cascata de coagulação e atividade fibrinolítica endógena resultam do estresse fisiológico, como grandes operações e traumatismo, e têm sido associados ao aumento do risco de trombose.
Lesão Venosa
Tem sido claramente estabelecido que a trombose venosa ocorre em veias distantes do local da operação; por outro lado, é também sabido que pacientes submetidos à prótese total de quadril frequentemente desenvolvem TVP no membro contralateral.
Em um grupo de grandiosos experimentos, as operações abdominais e de prótese total de quadril, em modelos animais, foram usadas para estudar a possibilidade de dano no endotélio venoso a distância do sítio da operação. Nesses experimentos, veias jugulares foram excisadas após os animais terem a perfusão estabelecida. Assim, demonstrou-se que o dano endotelial ocorrera após operações abdominais e era muito mais grave após operações no quadril. Ocorreram múltiplas microlacerações percebidas dentro das cúspides valvulares, que resultaram na exposição da matriz subendotelial. O exato mecanismo pelo qual ocorre essa lesão a distância, quais mediadores, se celulares ou humorais, ainda não é claramente entendido, mas a lesão ocorre, e sua existência neste e em outros estudos é evidente.
DIAGNÓSTICO
Incidência
O tromboembolismo venoso ocorre pela primeira vez em aproximadamente 100 pessoas por 100.000 a cada ano, nos Estados Unidos. A incidência cresce com o aumento da idade, sendo de 0,5% em 100.000, aos 80 anos de idade. Mais que dois terços destes pacientes só têm TVP, e os demais têm evidência de embolia pulmonar. A taxa de recidiva, com anticoagulação, tem sido notada em 6% a 7% nos seis meses subsequentes.
Nos Estados Unidos, a embolia pulmonar é causa de 50.000 a 200.000 mortes por ano. Tem sido observada uma taxa de mortalidade de 9,4% no 28" dia, após o primeiro episódio de TVP, e de 15,1% após o primeiro episódio de tromboembolismo pulmonar. Ao lado da embolia pulmonar, a FVC secundária (resultante de TVP) é significativa em termos de custo, morbidade e limitação do estilo de vida.
Para que as consequências da TVP, em relação à embolia pulmonar e FVC, sejam prevenidas, deve-se otimizar a profilaxia, o diagnóstico e o tratamento da TVP.
Diagnóstico Clínico
O diagnóstico da TVP requer, para usar uma frase muito comum, um alto índice de suspeição.
A maioria é familiarizada com o sinal de Homans, que se refere à dor na panturrilha quando fazer dorsiflexão do pé.
É certamente verdade que a ausência desse sinal não é um indicador confiável da ausência de tromboembolismo venoso; o achado de sinal de Homans positivo deve prontamente atentar para a confirmação do diagnóstico. Certamente a extensão da trombose venosa em membro inferior é um importante fator na manifestação dos sintomas. Por outro lado a maioria dos trombos na panturrilha pode ser assintomática a menos que haja propagação proximal. Esta é uma das razões pelas quais o teste de fibrinogênio marcado demonstra uma incidência mais elevada de TVP do que a incidência obtida pêlos estudos de imageneamento. Somente 40% dos pacientes com trombose venosa têm algumas manifestações clínicas desta condição.
Uma grande trombose venosa envolvendo o sistema venoso iliofemoral resulta em um maciço edema na perna com cacifo dor e palidez - uma condição conhecida como flegmasia alba dolens. Com a progressão adicional da doença, pode ha ver comprometimento do fluxo arterial pelo grande edema. Essa condição resulta em uma perna cianótica e muito dolorida condição chamada flegmasia cerúlea dolens. Com esta evolução da doença, a menos que o fluxo seja restabelecido.existe alto risco de haver desenvolvimento de gangrena venosa.
EXAMES PARACLINICOS
Venografía.
A injeção de meio de contraste no sistema venoso é óbvia e sabidamente o método mais acurado para confirmação e localização da TVP. O sistema venoso superficial tem sido ocluído com torniquete e tem sido injetado contraste nas veias do pé, para visualização do sistema venoso profundo. Portanto, trata-se de um bom exame para trombos oclusivos e não-oclusivos, sendo invasivo, sujeito aos riscos do contraste, e que requer interpretação com indice de erro de 5% a 10%.
Pletismografia por Impedância.
A pletismografia por impedância mede a alteração na capacitância venosa e o indice de esvaziamento do volume venoso na oclusão temperara na liberação desta. Um manguito é inflado ao redor da coxa proximal, até o sinal elétrico da onda atingir seu platô. Uma vez esvaziado o manguito, deve haver rápido refluxo e redução do volume. Com uma trombose venosa, nota-se um prolongamento da onda de refluxo. Não é muito usado clinicamente para detecção de trombose venosa na panturrilha e em pacientes com trombose venosa prévia.
Exames de Fibrina e Fibrinogênio.
A base da fibrina ou fibrinogênio pode ser avaliada pela medida da degradação da fibrina intravascular. O teste de D-dímero mede os produtos de degradação da fibrina, que é um substituto da atividade da plasmina na fibrina. É mostrado que, na combinação com avaliação e julgamento clínicos, a sensibilidade excede 90-95%. O valor preditivo negativo é de 99,3% para avaliação proximal e 98,6% para avaliação distal. No paciente em pós-operatório, o D-dímero está elevado, pela operação, e como tal não é usado para avaliação de TVP.
Entretanto, um teste de D-dímero negativo, em pacientes com suspeita de TVP. tem um alto valor preditivo negativo, variando de 97% a 99%.
Duplex Scan.
O moderno teste diagnóstico de escolha para o diagnóstico de TVP é o duplex scan, uma modalidade que combina Doppler ultra-sônico e imagem colorida de fluxo. Sua vantagem é não ser invasivo, abrangente e com qualquer risco da angiografia contrastada. Esse exame éi altamente dependente do operador e esta é uma das potenciais desvantagens.
O Doppler ultra-sônico é baseado no princípio do impedimento de um sinal de fluxo acelerado devido a um trombo intraluminar. Uma investigação detalhada começa na panturrilha, com imagens das veias tibiais e, então proximalmente, as veias poplítea e femoral. Um exame bem feito avalia o fluxo com compressão distal, que deve resultar em um aumento fluxo, e com compressão proximal, que deve interromper o mesmo. Se algum segmento do sistema venoso examinado apresentar incapacidade para demonstrar aumento à compressão, deve ser suspeito de trombose.
A ultra-sonografla modo-B em tempo real, com imagem colorida de fluxo, tem melhorado a sensibilidade e a especificidade do exame ultra-sônico. Com a dupla imagem, o fluxo sanguíneo pode ser mapeado na presença de uma oclusão trombótica parcial. O transdutor é usado também para comprimir a veia; uma veia normal deve ser facilmente comprimida, enquanto na presença de um trombo houver resistência á compressão. Adicionalmente, a cronicidade do trombo pode ser avaliada baseada nas características da imagem, mais especificamente no aumento da ecogenicidade e da heterogeneidade. A imagem dupla é significativamente mais sensivel do que a avaliação fisiológica indireta.
Venografía por Ressonância Magnética.
Com grandes avanços na tecnologia das imagens, a venografía por ressonância magnética está na linha de frente dos exames por imagem para doença venosa proximal. O custo e a questão da tolerância do paciente, devido à claustrofobia, limita a difusão de sua aplicação, porém isso está mudando. A venografia é um exame por imagem útil para veias ilíacas e veia cava inferior, uma area onde o duplex scan tem sua utilidade limitada.
PROFILAXIA
O paciente que sofreu operação de grande porte abdominal ou ortopédica, trauma grave ou imobilização prolongada (> 3 dias) apresenta um risco elevado de desenvolver tromboembolismo venoso. A análise dos fatores de risco específicos e os estudos epidemiológicos dissecando a etiologia do tromboembolismo venoso estão além dos objetivos deste capítulo. O leitor é referido para análises mais extensas deste problema.
Os métodos de profilaxia podem ser mecânicos ou farmacológicos.O método mais simples para o paciente é poder andar.
A ativação do mecanismo de bomba da panturrilha é um meio efetivo de profilaxia, como evidenciado pelo fato de que poucas pessoas sem fatores de risco subjacentes desenvolvem trombose venosa. Um paciente do qual se espera ser capaz de ficar de pé e andar em 24 a 48 horas tem um baixo risco de desenvolver trombose venosa. A prática de ter a paciente "fora da cama em uma cadeira" é a ordem mais trombogênica que alguém pode dar. Colocar o paciente sentado com as pernas pendentes causa um represamento do sangue, que, durante as alterações pós-operatórias, pode ser facilmente um fator predisponente para o desenvolvimento do tromboembolismo.
O método mais comum de profilaxia no universo cirúrgico tem recaído sobre os aparelhos de compressão sequencial, que comprimem periodicamente as panturrilhas e limitam essencialmente o mecanismo da musculatura da panturrilha. Isso tem reduzido a incidência de tromboembolismo venoso nos pacientes cirúrgicos. O mecanismo mais provável para a eficiência desse aparelho é, mais provavelmente, a prevenção da estáse venosa. Existe alguma literatura que sugere haver aumento sistemático da atividade fibrinolítica com o aparelho de compressão. Entretanto, isto não é estabelecido, já que existe um significativo número de estudos que não demonstram aumento da atividade fibrinolítica.
Outro método tradicional de tromboprofilaxia é o uso de "minidoses" fixas de heparina. A dose tradicionalmente usada é de 5.000 unidades de heparina não-fracionada, a cada 12 horas.
Entretanto, a análise de ensaios comparando placebo versus a dose fixa de heparina mostrou que esta não é mais efetiva que aquele. Quando a heparina é usada a cada 8 horas, em vez de 12 horas, existe uma redução no desenvolvimento de tromboembolismo venoso.
Mais recentemente, uma riqueza de literatura tem revelado a eficácia da heparina de baixo peso molecular fracionada para a profilaxia e o tratamento do tromboembolismo venoso.
- A heparina de baixo peso molecular fracionada inibe a atividade do fator Xá e IIA, com uma proporção de antifator Xá para o antifator IIA variando de 1:1 para 4:1.
- A heparina de baixo peso molecular fracionada tem a meia-vida plasmática elevada e uma biodisponibilidade significativamente maior.
- Existe uma resposta anticoagulante muito mais previsível do que com a heparina não-fracionada.
- Não é necessário acompanhamento laboratorial, porque o tempo de tromboplastina parcial (PTT) não é afetado.
- Uma grande variedade de estudos, incluindo uma grande metanálise, mostrou claramente que a heparina de baixo peso molecular fracionada apresenta resultados com equivalente, se não melhor, eficácia e significativamente menos complicações hemorrágicas.
- Comparações da heparina de baixo peso molecular fracionada com medidas mecânicas demonstraram a superioridade daquela na redução do desenvolvimento de doença tromboembólica
- Ensaios prospectivos avaliando a heparina de baixo peso molecular fracionada em pacientes com lesões cranianas e pacientes traumatizados têm provado sua segurança, pois não ocorreu aumento no sangramento intracraniano ou em outros locais.
- Adicionalmente, a heparina de baixo peso molecular fracionada demonstra redução no desenvolvimento do tromboembolismo quando comparada com outros métodos.
Em resumo, a heparina de baixo peso molecular fracionada deve ser considerada o melhor método de profilaxia em pacientes com riscos médio e alto. Mesmo a tradicional relutância em usar heparina em grupos de alto risco, como pacientes politraumatizados e com trauma cefálico, deve ser reexaminada, devido ao perfil eficaz e seguro da heparina de baixo peso molecular fracionada em múltiplos ensaios clínicos.
TRATAMENTO ANTICOAGULANTE ORAL
Uma vez feito o diagnóstico de trombose venosa, uma decisão deve ser tomada quanto a tratar ou não.
O tratamento da trombose venosa da panturrilha é controverso em vários círculos. É verdade que o risco de embolia pulmonar por trombose venosa da panturrilha é extremamente raro. Entretanto, a propagação do trombo venoso da panturrilha ocorre em mais de 30% dos pacientes hospitalizados. As sequelas, a longo prazo, da trombose venosa, envolvendo segmentos venosos mais proximais, é razão suficiente para se considerar a anticoagulação. Se não tratada, ocorre tromboembolismo recorrente em mais de 30% dos pacientes. Por esta razão, devemos defender intensamente a terapia com anticoagulante nos pacientes com trombose venosa da panturrilha, especialmente se a causa da TVP não for eliminada.
Se for tomada a decisão de não anticoagular, a repetição do duplex scan em três dias é recomendada e, ser for notada propagação proximal, a anticoagulação deve ser instituída.Qualquer tromboembolismo venoso envolvendo o sistema fêmoro-poplíteo deve ser tratado com anticoagulação plena.
Tradicionalmente, o tratamento da TVP está centrado na terapêutica com heparina, mantendo-se o PTT em 60 a 80 segundos, seguido pela terapia com warfarin, até obter uma Taxa de Normatização Internacional (INR) de 2,5 a 3,0. Se for usada heparina não-fracionada, é importante calcular a dose terapêutica baseada em um nomograma. A incidência de tromboembolismo venoso recorrente aumenta se o tempo até a anticoagulação terapêutica for prolongado. Por essa razão, é fundamental alcançar níveis terapêuticos dentro de 24 horas.
O regime usado amplamente é o de:
80 U/kg de heparina "em bolo", seguido por uma infusão de 15 U/kg.
O PTT deve ser avaliado seis horas após qualquer mudança na dosagem da heparina.
O warfarin é iniciado no mesmo dia. Se ele for iniciado sem heparina, existe o risco de um estado de hi-percoagulabilidade transitória, porque os níveis de proteínas C e S caem antes de os outros fatores da vitamina K dependentes serem depletados. Com o advento da heparina de baixo peso molecular fracionada, não é mais necessário submeter o paciente à terapia com heparina endovenosa. Atualmente, é uma prática aceita aplicar a heparina de baixo peso molecular fracionada aos pacientes como sendo ambulatoriais, funcionando como uma ponte para a terapia com warfarin, que é também monitorada ambulatorialmente.
A duração recomendada para a terapia anticoagulante continua em evolução. O tempo mínimo de tratamento de três meses é defendido na maioria dos casos. A taxa de recorrência é a mesma com três ou seis meses de terapia com warfarin. Se, entretanto, o paciente tem um conhecido estado de hipercoagulabilidade, ou já teve episódios de trombose venosa, é necessária anticoagulação por toda vida, na ausência de contra-indicações. A faixa aceita para o INR é de 2 para 3; um estudo recente, randomizado duplo-cego, confirmou que o INR entre dois e três foi mais efetivo na prevenção do tromboembolismo recorrente do que um regime de baixa intensidade com o INR de l para 1,9. Adicionalmente, o regime de baixa intensidade não reduz o risco de sangramento clinicamente importante.
TRATAMENTO DAS GRAVIDAS
A anticoagulação oral é teratogênica; portanto, não pode ser usada durante a gravidez. No caso de uma gestante com trombose venosa, a heparina de baixo peso molecular fracionada é o tratamento de escolha, sendo realizada, durante o parto e podendo ser continuado no pós-parto, se necessário.
Heparina não fracionada é uma mistura heterogênea de moléculas compostas por cadeias de polissacárides com peso molecular variando de 3.000 a 30.000 dáltons, média de 15.000 dáltons, correspondendo a 45 sacárides.
Heparinas de baixo peso molecular (heparina de baixo peso molecular fracionada) são fragmentos de heparina não fracionada obtidos por despolimerização química ou enzimática com peso molecular variando de 1.000 a 10.000 dáltons, média de cerca de 5.000 dáltons.
A heparina não fracionada e a heparina de baixo peso molecular fracionada exercem a sua ação anticoagulante através da ativação da antitrombina III, que tem a sua atividade acelerada em até 1.000 vezes no sentido de inibir os fatores da coagulação IIa e Xa e, em menor proporção, IXa, XIa e XIIa.
A ligação da heparina não fracionada e heparina de baixo peso molecular fracionada à antitrombina III depende da presença de uma única seqüência de pentassacárides contida em cerca de um terço das moléculas de heparina. Os dois terços restantes têm mínima atividade anticoagulante nas concentrações terapêuticas usuais.
Esta seqüência de pentassacárides confere alta afinidade da heparina não fracionada e heparina de baixo peso molecular fracionada pela antitrombina III. Qualquer molécula de heparina ou heparina de baixo peso molecular fracionada que contenha o pentassacáride pode inibir a ação Xa simplesmente pela ativação da AT III.
Para inativar a trombina (IIa), a heparina não fracionada ou heparina de baixo peso molecular fracionada tem que se ligar à antitrombina III e ao fator IIa simultaneamente, formando um complexo ternário, que só ocorre com cadeias mais longas, com pelo menos 18 sacárides, conforme abaixo:
Atualmente, um pentassacáride sintético, com atividade exclusivamente anti-Xa está em fase de avaliação clínica para prevenção e tratamento de TEV.
Além da redução do efeito anti-IIa, a heparina de baixo peso molecular fracionada apresenta outras vantagens farmacocinéticas em relação à heparina não fracionada:
1) Menor ligação a proteínas plasmáticas e proteínas de fase aguda.
2) Menor ligação aos macrófagos e células endoteliais.
3) Menor ligação às plaquetas e fator plaquetário 4 (PF4).
4) Menor ligação aos osteoblastos.
Tais diferenças proporcionam vantagens terapêuticas, como resposta anticoagulante mais previsível, meia vida plasmática mais longa, maior biodisponibilidade, redução da trombocitopenia induzida pela heparina – TIH e menor osteopenia. Estas propriedades permitem que as heparina de baixo peso molecular fracionada possam ser usadas uma ou duas vezes ao dia por via subcutânea, sem necessidade de linha venosa e bomba de infusão e com monitorização laboratorial mínima.
As heparinas de baixo peso molecular e algumas de suas características estão relacionadas abaixo:A TROMBÓLISE
O advento da trombólise resultou em um aumento do interesse desta para a TVP. O benefício proposto é a preservação da função valvular com, subsequentemente, menor possibilidade de desenvolver IVC. Entretanto, até o momento, existe pouca informação convincente para embasar o uso da terapia trombolítica para TVP.
Uma exceção é o paciente com flegmasia, no qual a trombólise é defendida para aliviar a significativa obstrução venosa. Nesta condição, a terapia trombolítica provavelmente resulta em um alívio maior dos sintomas e menos sequelas, a longo prazo, do que a anticoagulação com heparina isoladamente. A alternativa para essa condição é a trombectomia venosa cirúrgica. Independente de qual tratamento foi escolhido, a anticoagulação por longo prazo é indicada. A incidência de sangramento importante é maior com a terapia trombolíticaFILTRO DE VEIA CAVA
A complicação mais preocupante e potencialmente letal da TVP é a embolia pulmonar. Os sintomas de embolia pulmonar vão desde dispneia, dor torácica e hipoxia até um cor pulmonale agudo, não sendo específicos e necessitando de boa uma vigilância para que o diagnóstico seja feito. O padrão ouro permanece sendo a angiografia pulmonar, mas está sendo paulatinamente substituído pela angiotomografia computadorizada.
A anticoagulação adequada é usualmente efetiva em estabilizar a trombose venosa, mas se o paciente desenvolver embolia pulmonar na presença de anticoagulação adequada, esta indicado um filtro de veia cava. As indicações gerais para isso estão listadas abaixo:
- Tromboembolia recorrente, apesar da anticoagulação "adequada"
- Trombose venosa profunda em um paciente com contra-indicação para anticoagulação
- Embolia pulmonar crónica e decorrente hipertensão pulmonar
- Complicações da anticoagulação
- Propagação de trombo venoso iliofemoral com anticoagulação
Os filtros modernos são colocados por via percutânea sobre um fio-guia. O filtro de Greenfield, que é o mais usado e que possui o maior numero de informações, tem uma taxa de perviedade de 95% e uma taxa de embolia recorrente de 4%. Esta alta taxa de patência permite uma colocação supra-renal segura, caso haja comprometimento da veia cava inferior até acima das veias renais, ou a colocação em uma gestante próxima do trabalho de parto.
As complicações relacionadas ao filtro são:
- hematoma de ferida,
- migração do filtro para dentro da artéria pulmonar
- oclusão da veia cava por um grande êmbolo
No caso de oclusão da veia cava, a dramática hipotensão que a oclusão causa pode ser confundida com uma embolia pulmonar maciça, A distinção entre hipovolemia da oclusão da veia cava e falência do coração direito, devido à embolia pulmonar, pode ser verificada através da mensuração da pressão de enchimento do lado direito do coração.
O tratamento da oclusão de veia cava é a ressuscitação com volume.CONCLUSÕES SOBRE O TRATAMENTO CIRURGICO
Atualmente utilizam-se três tipos de operações para tratamento da IVC:
a) para a obstrução - Cirurgia de derivação em ponte, com ou sem fístula arteriovenosa;
b) para o refluxo - Cirurgia de transplante ou interposição de segmentos venosos valvulados;
c) para o refluxo - Cirurgia valvular direta ou valvuloplastias internas e externas.
As obstruções venosas podem ser tratadas por cirurgias de restauração do fluxo venoso por derivação, analogamente às técnicas de restauração arterial. A veia safena magna é o enxerto mais utilizado e geralmente indicado nas obstruções venosas femorais ou ilíacas. Pelo baixo fluxo venoso, deve-se associar ao procedimento derivativo uma fístula artériovenosa temporária (seis meses), com o objetivo de aumentar o fluxo venoso na região e assim prevenir a trombose. Nas obstruções ilíacas pode-se utilizar a técnica descrita em 1960 por PALMA, de derivação cruzada de veia safena magna, associada ou não à fístula arterio-venosa temporária, técnica introduzida por VÖLLMAR em 1974.
Nos casos em que o calibre da veia safena é inadequado, podem ser utilizadas próteses de dacron ou de politetrafluoretileno expandido (PTFE) anelado.
Quando o refluxo é o maior componente da IVC, as técnicas de reconstrução valvular podem oferecer um novo e promissor alento a estes pacientes. A valvuloplastia venosa realizada pioneiramente por KISTNER em 1968 foi utilizada fundamentalmente para tratar pacientes com refluxo valvular “primário”. Hoje, aceita-se que de 30 a 50% dos pacientes com síndrome pós-trombótica podem, de fato, ter um refluxo valvular “primário” como patologia básica e portanto suscetível de tratamento com as técnicas preconizadas por este autor. Para a insuficiência valvular primária (refluxo primário) utilizam-se técnicas de interposição de segmento valvulado de veia por transplante ou por transferência. Podem ser utilizados segmentos valvulados de veia axilar ou da própria veia femoral profunda competente.Nos casos de lesão valvular as técnicas de valvuloplastia direta passaram a ser utilizadas. Estas técnicas foram descritas por acesso direto intra-luminal ou mesmo por valvuloplastia externa, extra-luminal. Os resultados a longo-prazo das operações de valvuloplastia estão sendo ainda analisados. Não devem ser relegadas, entretanto, a segundo plano as operações nos sistemas venosos superficiais tais como a safenectomia interna e externa e ligadura das veias perfurantes insuficientes.
A doença venosa, em perspectiva cirúrgica, é frustrante. Entretanto, as consequências da insuficiência venosa, assim como da trombose venosa, é debilitante, cara e associada a uma significativa morbidade, em termos de condição inicial, assim como das sequelas. Um bom conhecimento da doença, dos fatores de risco e do tratamento irá resultar em melhor prevenção e tratamento da doença, no futuro próximo. Os últimos 20 anos têm visto grandes avanços nas habilidades diagnosticas, em termos de imagem, assim como no entendimento dios estado de hipercoagulabilidade. Avanços cirurgicos, como a cirurgia subfascial endoscopica das perfurantes tem tido resultados mistos, porém, de maneira geral, a trajetoria e para frente, apesar de pequenos passos
FORMAS ESPECIAIS DE TROMBOSE VENOSA:
TVP DO MEMBRO SUPERIOR
Raramente aparece aos homens (normalmente aos homens de 2-40 anos depois um esforço fisico) ou secundariamente a um cateterismo, fratura de clavicula, causado pelo um hematoma, tumora, adenopatia. Manifesta-se com edema (apagando a fossa supraclavicular) estáse venosa, palidez da pele da mão.
TVP PELVICA
Normalmente aparece pos-parto, pos-aborto - e uma extensão da trombose dos seios uterinos ate as veias uterinas, que drena tambem as veias da bexiga urinaria. tambem, pode surgir depois as cirurgias na pequena bacia.
Sintomatologia - manifesta-se com a triade: U I U (urinar, intestinal, uterina)
1) sinais urinarias: disuria, polakiuria, incontinencia ou retenção de urina,evolução possivel ate um sindrome nefrotico ou IRA
2) sinais intestinais: dor anal, tenesemas, intestino preso, edem da mucosa retal, hemorroides
3) sinais uterinos:
- fundo de sac Douglas e de consistencia pastosa
- tumefação genital externa (o escroto o penis, os labios grandes)
- aumento da temperatura retal (maior que a temperatura bucal)
TVP DA CAVA INFERIOR
incidencia rara (o fluxo venoso e rapido neste nivel) e mais frequente como uma trombose ilio-femural, ovariana, renalou suprahepatica, ou podeser causada pela uma compressão. Causa edemas gigantes (elefantiase) + circulação acentuada na metade inferior do tronco e na base das coxas.
A extensãosuprahepatica pode causar o sindrome Budd Chiari (ascite, hepatoesplenomegalia, insuficiencia hepatica, hemorragia digestiva superior, dores abdominais.
Tambem, existe a possibilidade de extensão ate o rim,produzindo infarto renal e IRA.
MISODOR, 22 JULHO 2008, ATUALIZADO EM 19 NOVEMBRO 2008
BIBLIOGRAFIA:
1. SABISTON - TRATADO DE CIRURGIA 17-A EDIÇÃO VOL II
2. Moser KM. Venous thromboembolism. Am Rev Respir Dis
2. Anderson FA, Wheller HB, Goldberg RJ, Hosmer DW, Patwardhan NA, Jovanovic B, et al. A population-based perspective of the hospital incidence and case-fatality rates of deep vein thrombosis and pulmonary embolism: the Worcester DVT study. Arch Intern Med 1991;
3. Stein PD, Huang H, Afzal A, Noor HA. Incidence of acute pulmonary embolism in a general hospital. Chest 1999;116:909-13.
4. Dismuke SE, Wagner EH. Pulmonary embolism as a cause of death. JAMA 1986;255:2039-42.
5. Lindblad B, Sternby NH, Bergqvist D. Incidence of venous thromboembolism verified by necropsy over 30 years. Br Med J 1991
6. Maffei FHA, Faleiros ATS, Venezian CA, Franco MF. Contribuição ao estudo da incidência e anatomia patológica do tromboembolismo pulmonar em autópsias. Rev Assoc Med BrasTodos os direitos reservados. 2025.
A VITÓRIA É SOMENTE SUA! O CAMINHO É NOSSO!
O site misodor.com.br está online desde 04 de novembro de 2008
O nome, o logo e o site MISODOR são propriedade declarada do webmaster
Qualquer conteudo deste site pode ser integralmente ou parcialmente reproduzido, com a condição da menção da fonte.